Clone di Trattamento topico della dermatite indotta da radiazioni

DRUGS IN CONTEXT
RIGOROUS – RAPID – RESPONSIVE
A continuous publication, open access, peer-reviewed journal
Trattamento topico della dermatite indotta da radiazioni: attuali problemi e possibili soluzioni
Nicola Alessandro Iacovelli MD(1), Yvan Torrente MD, PhD(2,3), Adriana Ciuffreda MD(4), Vittorio A Guardamagna MD, PhD(5,6), Marta Gentili MS(7), Luca Giacomelli PhD(8,9), Paola Sacerdote PhD(10)
(1)Radiation Oncology Unit 2, Fondazione IRCCS Istituto Nazionale dei Tumori di Milano, Milan, Italy; (2)Stem Cell Laboratory, Department of Pathophysiology and Transplantation, Universitá degli Studi di Milano, Milan, Italy; (3)Unit of Neurology, Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico, Centro Dino Ferrari, Milan, Italy; (4)Medico Chirurgo, Specialista in Dermatologia e Venereologia, Dermatologia Pediatrica, Milan, Italy; (5)Division of Palliative Care and Pain Therapy, IRCCS Istituto Europeo di Oncologia IEO, Milan, Italy; (6)Director of ESMO, Designated Center of Integrated Oncology and Palliative Care, Milan, Italy; (7)Research Biologist, Private Practice, Milan, Italy; (8)Polistudium SRL, Milan, Italy; (9)Department of Surgical Sciences and Integrated Diagnostics, University of Genoa, Genoa, Italy; (10)Department of Pharmacological and Biomolecular Science, University of Milano, Milan, Italy
ABSTRACT
Sostanzialmente, circa il 95% dei pazienti sottoposti a radioterapia (RT) sviluppa dermatite indotta da radiazioni (RID) durante o dopo il trattamento, con importanti conseguenze sulla qualità della vita e gli esiti del trattamento. Questo lavoro esamina la patofisiologia della RID e i prodotti topici attualmente usati per la sua prevenzione e il suo trattamento. Sebbene non vi sia consenso sul trattamento appropriato, recenti evidenze indicano che l’uso di prodotti topici contribuisce a proteggere e promuovere la riparazione tissutale nei pazienti con RID. Tra le raccomandazioni di base figurano quella di indossare vestiti larghi, usare rasoi elettrici se necessario ed evitare prodotti cosmetici, esposizione al sole o temperature estreme. A seconda dei meccanismi coinvolti e delle caratteristiche cliniche dei pazienti oncologici, è possibile delineare il profilo del prodotto topico ideale per trattare la RID; tale prodotto deve avere un rischio limitato di eventi avversi, assorbimento sistemico e interazioni farmaco-farmaco, essere caratterizzato da molteplici attività cliniche, con uno speciale focus sul dolore localizzato, e avere un’accurata formulazione poiché alcuni veicoli possono bloccare il raggio della RT.
Parole chiave: dolore, qualità della vita, dermatite indotta da radiazioni, radioterapia, tossicità cutanea, trattamento topico
CITAZIONE
Iacovelli NA, Torrente Y, Ciuffreda A, Guardamagna AV, Gentili M, Giacomelli L, Sacerdote P. Topical treatment of radiation induced dermatitis: current issues and potential solutions. Drugs in Context 2020; 9: 2020-4-7. DOI: 10.7573/dic.2020-4-7
INTRODUZIONE
La dermatite indotta da radiazioni (RID) è un effetto collaterale molto comune che si manifesta in quasi tutti i pazienti sottoposti a radioterapia (RT) per il trattamento di un cancro. La RID è prodotta da lesioni cutanee o sottocutanee a causa delle radiazioni a fasci esterni. Infatti, si stima che circa il 95% dei pazienti riceventi RT finiscano con lo sviluppare RID durante o dopo il trattamento, con importanti conseguenze sulla qualità della vita e l’adesione ai trattamenti radioterapici, influenzando quindi gli esiti clinici.(1–3) Tuttavia, al momento, non vi è consenso sul trattamento appropriato di tale patologia. Pertanto, servono urgentemente nuove conoscenze per garantire una gamma di opzioni terapeutiche disponibili per il trattamento della RID.(1)
Recenti evidenze indicano che per proteggere e promuovere la riparazione tissutale nei pazienti con RID, anche in ambito profilattico, potrebbero essere utilizzati prodotti topici.(4,5)
Lo scopo del presente lavoro è discutere delle attuali conoscenze sulla RID e proporre target per la prevenzione/il trattamento di tale patologia. Su queste basi, verranno descritte le caratteristiche del composto ‘ideale’ per contrastare tale effetto collaterale.
I manoscritti considerati nel presente lavoro sono stati rintracciati tramite una ricerca su PubMed, usando parole chiave pertinenti (ad esempio, dermatite indotta da radiazioni). Successivamente, si è proceduto alla selezione dei lavori da includere in base alla loro attinenza al tema, come giudicata dagli autori. Sono stati consultati anche gli elenchi di riferimento dei lavori per individuare altre pubblicazioni adeguate. Inoltre, sono stati considerati i lavori presenti nelle collezioni personali di letteratura degli autori.
RID: CONCETTI DI BASE
Manifestazioni cliniche
Tra i sintomi chiave di RID figurano dolore, ulcerazione, gonfiore, prurito, bruciore e malessere fisico e psicologico. Inoltre, possono insorgere infezioni opportunistiche.(6–9) Sebbene tali lesioni potrebbero risolversi con il tempo, possono profondamente influire sulla qualità della vita e limitare anche la durata del trattamento e la dose di radiazioni somministrata, con importanti conseguenze sugli esiti terapeutici.(4,10)
Solitamente, la gravità della RID viene valutata dal medico secondo strumenti standard, come la scala CTCAEs (Common Terminology Criteria for Adverse Events, Criteri terminologici comuni per gli eventi avversi) (versioni 2.0, 3.0, 4.0, or 4.03) o la scala RTOG/EORTC (Radiation Therapy Oncology Group/European Organization for Research and Treatment of Cancer).(2) Tuttavia, a volte nella pratica clinica, insieme alla scala CTCAE vengono utilizzati strumenti di rilevazione degli esiti riferiti dal paziente (PRO) (ad es., lo Skindex-16 o il Brief Pain Inventory [BPI]).(2) Fino al 90% dei pazienti sviluppa reazioni cutanee lievi (grado 1) e circa il 20% dei pazienti sviluppa forme gravi della patologia.(11) Sorprendentemente, trattamenti sistemici concomitanti (ad es., regimi a base di platino, cetuximab, 5-fluorouracil), somministrati a una buona percentuale di pazienti sottoposti a RT, possono aumentare la gravità della RID.(2)
La RID è caratterizzata da una reazione acuta quando si manifesta al momento della terapia e può essere cronica o a insorgenza tardiva quando compare mesi o anni dopo la fine del trattamento. Reazioni cutanee precoci alla RT solitamente si verificano nel giro di qualche giorno o settimana dall’inizio, mentre i cambiamenti tardivi possono avvenire anche mesi o anni dopo la fine di un percorso di RT.
Di solito, una fase acuta di RID è definita da lesioni cutanee che compaiono entro 90 giorni dall’inizio del trattamento. Inizialmente, la lesione può manifestarsi come eritema transitorio, che potrebbe essere segnalato già entro 24 ore dall’inizio della RT e si risolve in pochi giorni (Figura 1).(12,13) Successivamente, dalla seconda alla quarta settimana di terapia, possono essere segnalati un eritema generalizzato più intenso e l’insorgenza di dolore, spesso associati ad altri mutamenti cutanei, come secchezza e iperpigmentazione. Dalla terza alla sesta settimana (dall’inizio della terapia), se la dose cumulativa di radiazioni raggiunge 20 Gy può svilupparsi desquamazione secca associata a dolore, prurito e formazione di squame, mentre se la dose totale di radiazioni sulla cute è ≥40 Gy può verificarsi desquamazione umida.(14) In quest’ultimo caso, potrebbe rendersi necessaria una temporanea interruzione della RT, finché l’area non è in grado di riepitelializzarsi.(15)
Le reazioni cutanee croniche alla RT si sviluppano più di 90 giorni dopo il completamento del trattamento radioterapico.(12) Tali reazioni includono lesioni vascolari che determinano telangiectasia, assottigliamento epidermico, atrofia dermica, pigmentazione, fibrosi, edema, cheratosi e persino necrosi del derma. Inoltre, i pazienti mostrano un rischio aumentato di sviluppo di malignità cutanee non melanotiche nel corso della loro vita.
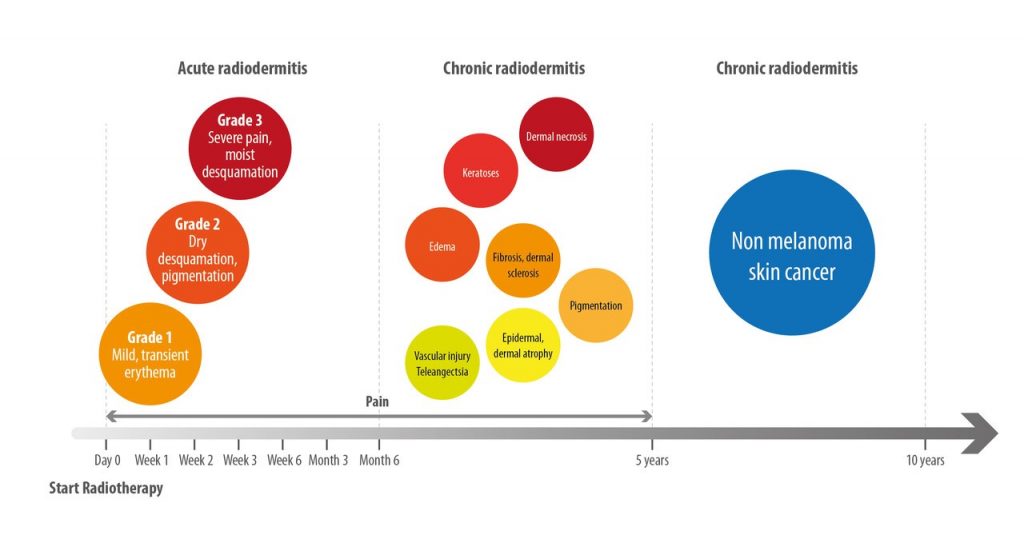
Patofisiologia
Le lesioni da RT originano dalla produzione di radicali liberi e specie reattive dell’ossigeno nelle cellule in rapida divisione dello strato basale e del derma sottostante.(12) Entro alcune ore dall’inizio del trattamento, tale azione riduce il numero di cellule staminali funzionali, induce mutamenti nelle cellule endoteliali e incentiva l’infiammazione tramite il rilascio di diverse citochine e chemochine, in particolare interleukina (IL)-1α, IL-1β, fattore di necrosi tumorale-α, IL-6, IL-8, chemochina C-C ligando 4 (CCL4), chemochina C-X-C ligando 10 (CXCL10) e chemochina C-C ligando 2 (CCL2). Nelle successive due-quattro settimane, si sviluppa un forte eritema generalizzato, che molto probabilmente si associa a degenerazione locale ed edema, risultante dall’infiltrazione di leucociti nella cute irradiata, un tratto peculiare di lesione cutanea indotta da radiazioni. Secchezza ed epilazione, spesso osservati in questa fase del decorso della RID, sono il risultato della distruzione delle ghiandole sebacee e dei follicoli piliferi.(17–19)
Inoltre, a differenza di altre forme di danno meccanico o chimico alla cute, il danno indotto dalla RT è ripetitivo e si accumula nel corso del trattamento, conducendo anche a una disgregazione ritardata della barriera epidermica. Infatti, gli effetti cronici indotti dalla RT includono cambiamenti della vascolarizzazione e del tessuto connettivo degli strati cutaneo e sottocutaneo. Il rimodellamento dell’epitelio può poi determinare la formazione di teleangiectasie.(20) Con l’accumularsi delle dosi di radiazioni, se il processo di guarigione basato sui fattori di crescita, come il fattore di crescita dei fibroblasti (FGF) o il fattore di crescita dell’epidermide (EGF), risulta compromesso, possono essere distrutti 21 melanociti e fibroblasti, causando ipopigmentazione e atrofia del derma.(12)
EPIDEMIOLOGIA DELLA RID
La RID è un effetto collaterale comune, anche se spesso negato, della RT. Infatti, almeno il 50% dei pazienti affetti da un qualsiasi tipo di cancro riceve una qualche forma di RT durante il corso della malattia.(4) Tale prevalenza è ancora più elevata in pazienti con tumore della testa e del collo e carcinoma mammario; si stima che l’80-90% di tutti i pazienti con tumore della testa e del collo sottoposti a RT sviluppa RID e il 25% sviluppa gravi reazioni cutanee.(22) Nel contesto del carcinoma mammario, una delle forme più diffuse di cancro in tutto il mondo, il 45% delle pazienti riceve RT e la stragrande maggioranza di esse (74-100%) segnala RID.(23) Inoltre, una RID cronica si sviluppa in una paziente su tre e può manifestarsi fino a 10 anni dopo il completamento della RT.(24) Poiché >80% di tutte le donne trattate per carcinoma mammario sopravvive ≥10 anni, il burden della RID cronica cresce sempre di più.(25) Il rischio di sviluppare RID dipende da vari fattori correlati al trattamento: la dose di radiazioni durante una singola somministrazione, la dose totale, la durata dell’esposizione, il volume dell’area trattata e l’associazione ad altre terapie, come la chemioterapia.(26) Oltre a ciò, la RID può essere influenzata da fattori correlati al paziente quali indice di massa corporea (IMC) elevato, fumo, stato nutrizionale, malattie cutanee preesistenti, come la psoriasi, e suscettibilità genetica.
Danni cutanei sono stati associati anche alla chemioterapia, sebbene l’incidenza di tale evento non sia stata stimata con precisione.(26) Degno di nota è il fatto che la dermatite da radiazioni è una reazione infiammatoria acuta della pelle che si verifica in un’area cutanea già esposta a RT ed è innescata dalla successiva assunzione di un farmaco, più comunemente un agente chemioterapico. L’incidenza della dermatite da radiazioni non può essere determinata con precisione, giacché la maggior parte delle evidenze proviene da case report. Comunque, l’effetto è stato segnalato in associazione all’uso di diversi farmaci antineoplastici.(27)
IL FONDAMENTO E LE BASI PER IL TRATTAMENTO DELLA RID
Ad oggi, il trattamento della RID è ancora basato su evidenze preliminari.(4) Infatti, al momento, non è possibile proporre alcuna raccomandazione solida per prevenire o ridurre la RID.(2,4,20,28,29)
Tuttavia, è possibile delineare alcune raccomandazioni di base, in linea con quelle della Multinational Association of Supportive Care in Cancer (MASCC)(20): ai pazienti dovrebbe essere consigliato di indossare vestiti larghi, usare rasoi elettrici (se necessario) ed evitare prodotti cosmetici, esposizione al sole e temperature estreme.(12) Inoltre, durante i trattamenti di RT è obbligatoria una valutazione regolare della cura della pelle.
In pazienti con diverse comorbilità, spesso politrattati e fragili, come accade molto spesso nella popolazione oncologica, per il trattamento della tossicità della pelle la migliore opzione iniziale potrebbe essere rappresentata da sostanze topiche.(1,30–32)
È comunemente accettato che il trattamento topico quotidiano potrebbe essere utile se avviato proprio all’inizio della RT per prevenire l’insorgenza di RID.(4)
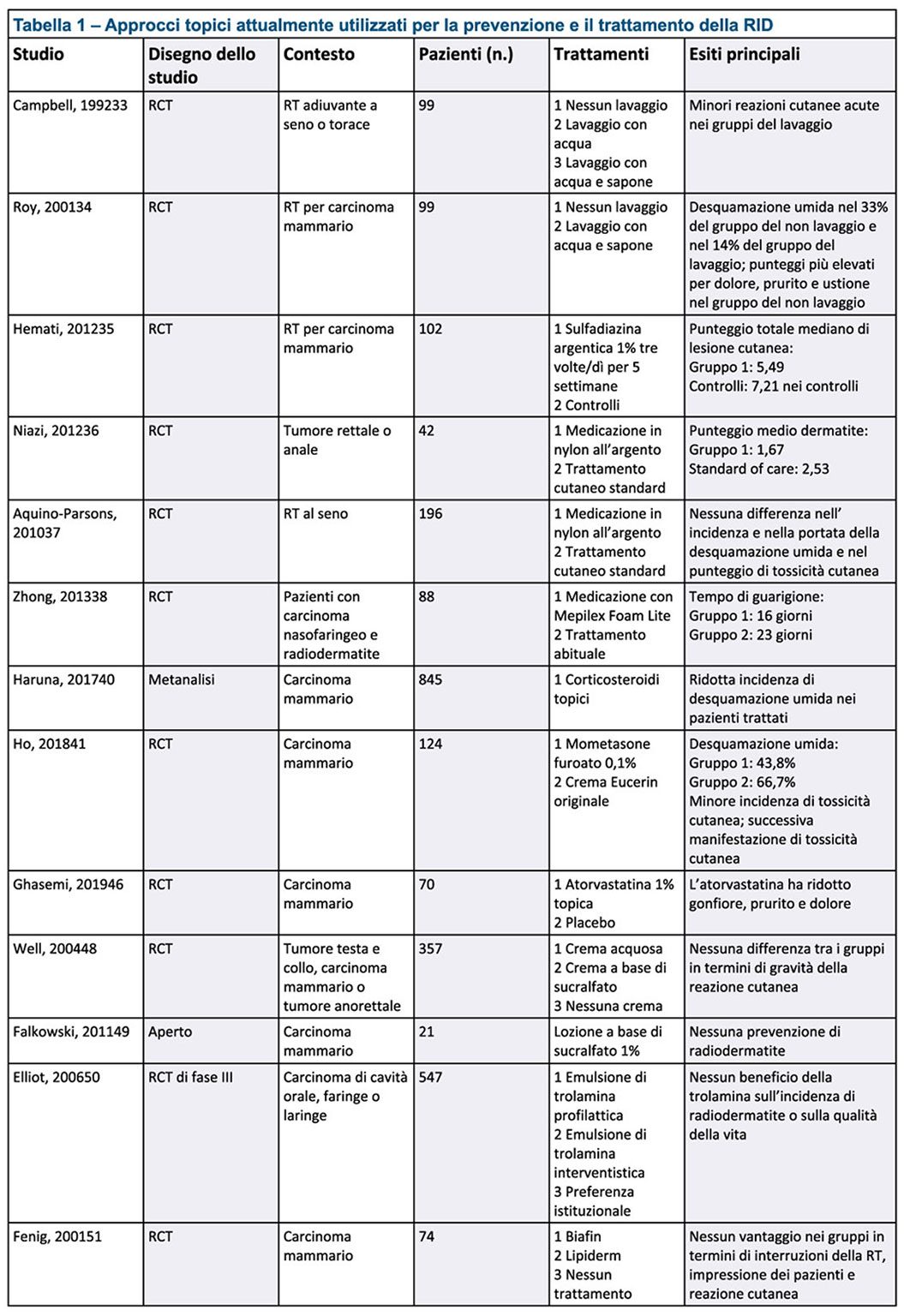
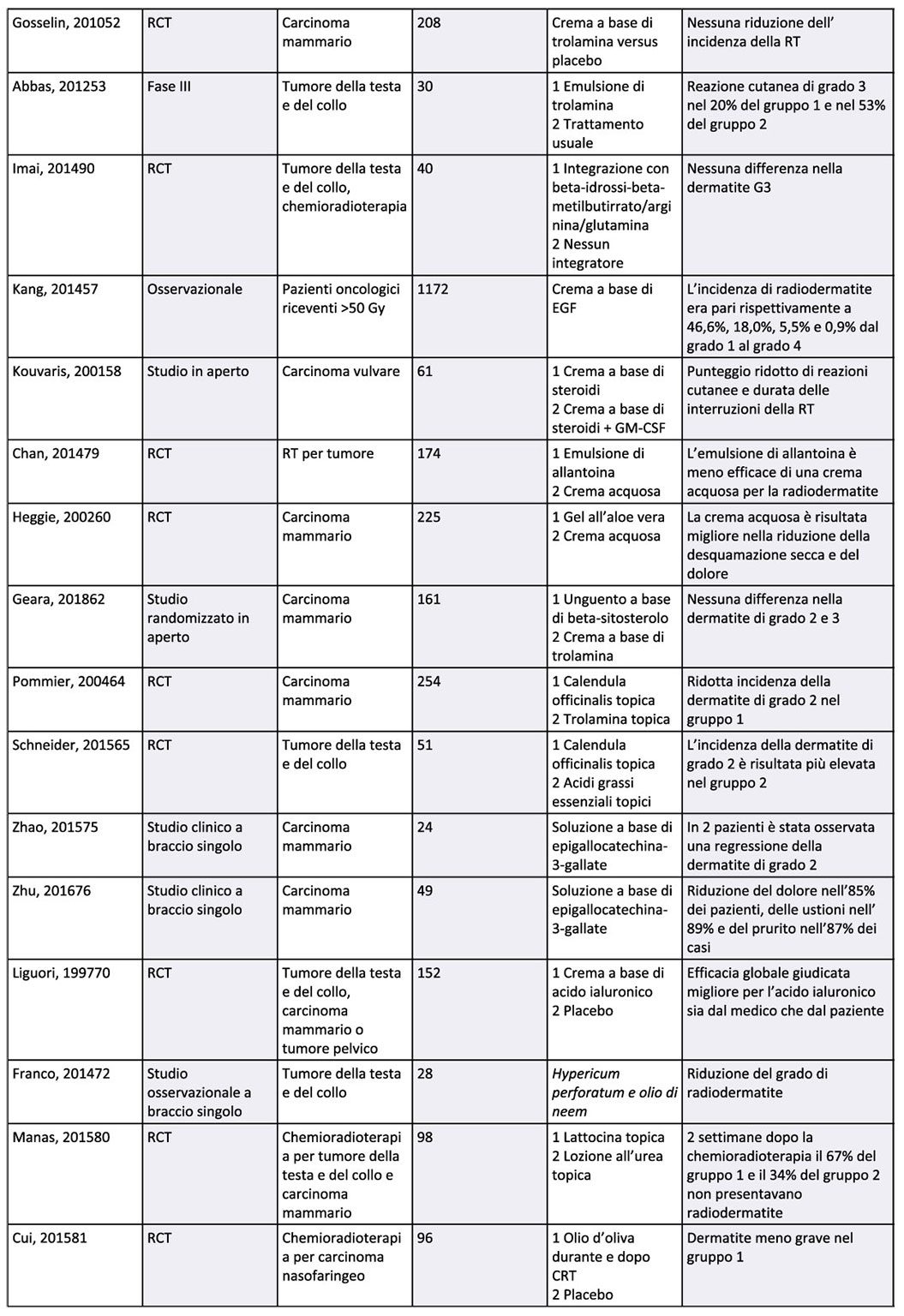
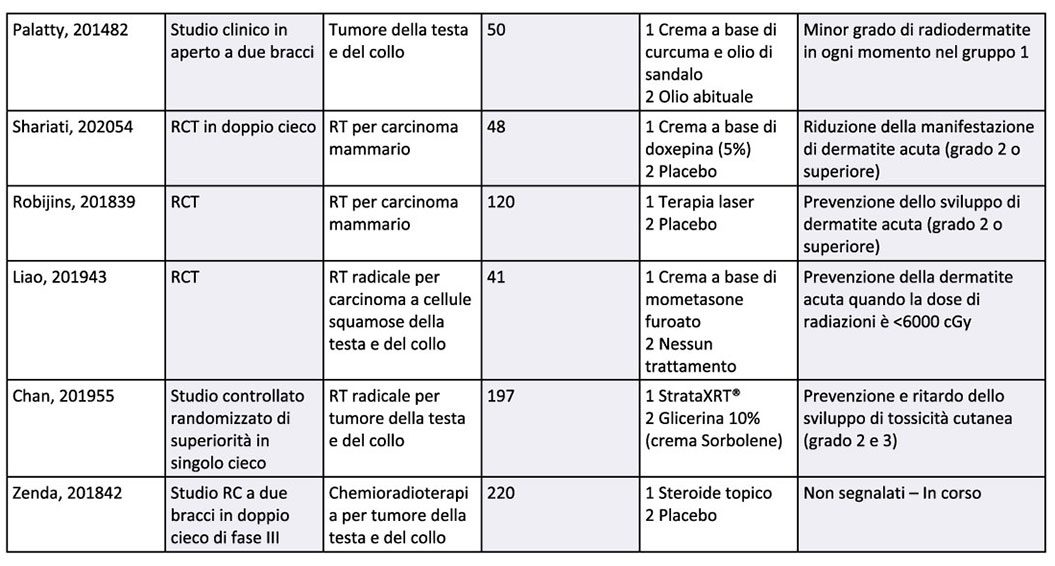
Le informazioni disponibili sugli approcci topici attualmente utilizzati per la prevenzione e il trattamento della RID sono presentati nella Tabella 1, mentre un quadro di questi approcci è delineato nella sezione che segue.
DIVERSI TRATTAMENTI PER LA RID: UN QUADRO GENERALE
Lavaggio
Seguire le pratiche igieniche standard è senza dubbio la scelta più vantaggiosa nel trattamento della RID. Due studi controllati randomizzati (RCT) ben condotti hanno mostrato che lavarsi con sapone delicato e acqua tiepida riduce il prurito e la gravità della RID.(33,34)
Medicazioni
La sulfadiazina argentica, un antibatterico topico, è usata come crema per ustioni di secondo e terzo grado. Questa molecola è dotata anche di proprietà antinfiammatorie e funzioni di potenziamento della barriera, contribuendo quindi a proteggere la pelle da agenti infettivi.(1) In uno studio preliminare, l’uso di medicazioni contenenti sulfadiazina argentica è risultato associato a una gravità complessiva inferiore della RID.(35) Risultati simili sono stati segnalati per la medicazione in nylon all’argento(36,37) o con Mepilex Foam Lite.(38)
Nota: CRT, chemioradioterapia; GM-CSF, fattore stimolante le colonie granulocitarie-macrofagiche; RCT, studio controllato randomizzato; RT, radioterapia
Terapia laser
Nelle pazienti con carcinoma mammario è stata testata la terapia di fotobiomodulazione dopo la seduta di RT due volte a settimana. L’efficacia del trattamento è stata valutata tramite un questionario sulla qualità della vita e ne è emerso un effetto benefico.(39)
Agenti farmacologici e biologici
I corticosteroidi topici vengono comunemente prescritti per la RID grazie alla loro capacità di contrastare il rilascio di citochine indotto dalle radiazioni.(32) Anche se l’efficacia di questa strategia terapeutica è consolidata nel carcinoma mammario(40,41) ed è attualmente in corso di valutazione nel tumore della testa e del collo,(42,43) l’uso dei corticosteroidi topici è frequentemente associato all’insorgenza di eventi avversi clinicamente rilevanti.(44) In particolare, l’uso prolungato di steroidi determina un assottigliamento della pelle, che può essere particolarmente controindicato in questa patologia. Le statine mostrano proprietà antinfiammatorie, immunomodulatorie, antiossidanti, metaboliche e antibatteriche e possono essere efficaci per la riduzione della gravità delle patologie cutanee, come psoriasi, dermatite, prurito uremico e vitiligine.(45) In un’esperienza preliminare, Ghasemi e colleghi hanno studiato l’uso topico dell’atorvastatina.(46)
Nella sua formulazione topica, il sucralfato presenta capacità di barriera, attività antibatterica, effetti antinfiammatori e capacità di promozione dell’angiogenesi.(47) Tuttavia, il sucralfato non ha ridotto la gravità della RID o migliorato i sintomi riferiti dai pazienti.(48,49)
La trolamina è ampiamente utilizzata nel trattamento della RID poiché si presume che funga da molecola antinfiammatoria non steroidea.(1) Tuttavia, diversi RCT non hanno mostrato alcun vantaggio della trolamina rispetto alla terapia di supporto o persino al placebo nel trattamento della RID.(50–53) È stato recentemente mostrato che la crema di doxepina previene la dermatite quando applicata dopo RT nelle pazienti con carcinoma mammario.(54)
Gli agenti a base di silicone in vitro hanno dimostrato di regolare la fibrosi e la guarigione delle ferite, sebbene con una possibile inconvenienza pratica a causa della non perfetta aderenza alla pelle quando ci si lava e negli uomini con peli sul viso. StrataXRT®, un agente a base di silicone che forma una pellicola, è risultato efficace nel ritardare lo sviluppo di tossicità cutanea.(55)
L’EGF stimola la proliferazione delle cellule staminali epidermiche umane, dei fibroblasti e dei cheratinociti, contribuendo quindi alla guarigione delle lesioni cutanee.(56) Secondo Kang e colleghi, l’EGF topico determina un’incidenza ridotta di tossicità in confronto ai dati storici.(57)
Il fattore stimolante le colonie granulocitarie-macrofagiche (GM-CSF) promuove la maturazione e l’attività dei macrofagi. Rispetto ai pazienti trattati solo con steroidi topici, quelli riceventi steroidi topici e garze imbevute di GM-CSF hanno mostrato una ridotta severità della RID e un dolore meno pronunciato.(58)
Agenti non farmacologici
Diversi agenti non farmacologici sono stati proposti per il miglioramento della RID. Qui, esaminiamo i trattamenti topici disponibili e un agente da assumere per via orale. Gli agenti sono stati classificati in base alla loro proprietà principale. Ciò non esclude che un agente possa presentare più di una sola caratteristica.
Agenti antinfiammatori
- L’aloe vera è una terapia omeopatica antinfiammatoria dotata di capacità protettive e di guarigione.(59) Tuttavia, nonostante queste caratteristiche promettenti, l’aloe vera non riduce la gravità della RID.(60)
- Il beta-sitosterolo è una formulazione omeopatica che presenta effetti antibatterici, analgesici e antinfiammatori.(61) In un recente studio clinico, beta-sitosterolo e trolamina non si associavano a miglioramenti importanti della RID, sebbene l’incidenza di prurito forte e dolore locale risultassero significativamente ridotti con il beta-sitosterolo.(62)
- La calendula officinalis ha capacità antinfiammatorie, antibatteriche, antimicotiche, antiossidanti e angiogeniche.(63) In un RCT, la calendula ha significativamente ridotto la frequenza della dermatite acuta di grado ≥2 rispetto alla trolamina (41 versus 63%, p<0,001). Inoltre, i pazienti assegnati alla calendula hanno richiesto minori interruzioni della RT e hanno segnalato un dolore meno acuto.(64) Tali risultati sono stati confermati in uno studio pilota randomizzato più recente.(65)
- L’acido ialuronico (HA) è ampiamente utilizzato nelle medicazioni delle ferite, in prodotti sostitutivi per la pelle e in altre applicazioni nel campo della medicina rigenerativa e della dermatologia.(66,67) L’HA è usato nelle forme ad alto e a basso peso molecolare e l’uso di forme coniugate ad alto e a basso peso molecolare può ulteriormente aumentare l’efficacia di questo composto in modo sinergico.(68) IIn vitro, l’HA ha protetto i fibroblasti dai danni delle radiazioni,(69) e in un RCT in doppio cieco è stato in grado di ridurre l’incidenza della RID grave in 152 pazienti sottoposti a RT per carcinomi della testa e del collo, mammari o pelvici.(70) Recenti evidenze supportano anche l’uso dell’HA per somministrazione topica in pazienti con patologie infiammatorie a livello della mucosa.(71)
- In uno studio pilota, Franco e colleghi hanno valutato in modo prospettico il ruolo dell’Hypericum perforatum e dell’olio di neem nel trattamento della tossicità cutanea acuta.(72) Questo approccio è stato preliminare e ha indicato di essere sicuro e attivo per il trattamento di tale patologia.
- La glutamina è stata proposta per prevenire RID orale e mucosite. Tuttavia, uno studio sull’efficacia della glutamina orale non ha mostrato alcun effetto significativo sulla gravità della mucosite orale.(73)
Agenti antiossidanti
- Le catechine, in particolare l’epigallocatechina-3-gallato (EGCG), presentano attività antiossidanti che potrebbero promuovere la guarigione del danno cutaneo causato dall’esposizione alla luce ultravioletta.(74) In uno studio di fase I/II, l’EGCG topica ha mostrato diversi effetti benefici.(75,76)
- Anche le vitamine sono state testate in questo contesto. L’acido ascorbico è dotato di potenti capacità antiossidanti e di pulizia dei radicali liberi. Tali caratteristiche hanno condotto Halperin e colleghi a studiare il possibile ruolo protettivo dell’acido ascorbico nella RID, ma il loro studio non è riuscito a dimostrare un beneficio dell’acido ascorbico topico in questo ambito.(77) L’acido pantotenico (vitamina B5) ha un ruolo centrale nel metabolismo ed è essenziale per l’integrità della normale cute. Tuttavia, quando confrontato con l’assenza di trattamento, una crema topica con acido pantotenico non è riuscita a dimostrare un effetto protettivo potenziato contro la RID.(78)
- Le preparazioni topiche che contengono estratto di sinfito, che comprende l’allantoina, potrebbero avere applicazioni nel trattamento dell’irritazione della pelle. Infatti, in uno studio in doppio cieco, i pazienti assegnati alla crema contenente allantoina presentavano una minor intensità di dolore e prurito alla terza settimana rispetto a quelli trattati con crema acquosa.(79)
- La lattocina è una proteina derivata dal latte. In uno studio pilota, la somministrazione topica di un prodotto contenente lattocina è risultata efficace per la prevenzione e riduzione del grado di RID nei pazienti con tumore della testa e del collo e carcinoma mammario.(80)
- In un RCT su 94 pazienti con tumore della testa e del collo, la RID acuta risultante si è ridotta di intensità con l’applicazione di olio d’oliva.(81) n un altro piccolo studio randomizzato su 50 pazienti, una crema contenente curcuma e olio di sandalo è stata in grado di prevenire l’insorgenza di RID, ma i risultati richiedono un’ulteriore validazione in studi in doppio cieco più ampi.(82)
DAL LABORATORIO ALLA PRATICA CLINICA: COME MIGLIORARE IL TRATTAMENTO DELLA RID
La RID ha un forte impatto sulla qualità della vita dei pazienti affetti da cancro e può interferire con le terapie oncologiche, riducendo quindi il loro effetto.(4) In particolare, il dolore è percepito come uno dei sintomi più forti associati a RID,(7) e anche altri sintomi presentati dai pazienti, come prurito e ustioni, risultano seccanti.
Da una prospettiva di ricerca di base, una migliore comprensione dei meccanismi dei danni alla pelle indotti dalle radiazioni daranno l’opportunità di programmare meglio sia le strategie preventive che curative. Inoltre, serve un grande sforzo per rilevare fattori predittivi per l’insorgenza e la gravità della RID, anche a livello genomico.(2)
È importantissimo condurre appropriati studi epidemiologici e indagini nazionali per delineare un quadro più chiaro dell’incidenza della RID e degli approcci terapeutici nei diversi centri (ad esempio, centri che offrono cure primarie versus centri specialistici).
Riquadro 1. Consigli pratici per il trattamento clinico della RID
- Lavare quotidianamente la pelle sottoposta a radiazioni con acqua tiepida e un sapone con un pH delicato, neutro o non alcalino
- Radersi con un rasoio umido affilato e disinfettato o con un rasoio elettrico non traumatizzante
- Evitare temperature estreme ed esposizione al sole
- Evitare l’uso di prodotti topici a base metallica, profumi, cerotti e adesivi
- Scegliere un prodotto topico appropriato per ciascun paziente per mantenere la pelle idratata
- Un prodotto topico non deve essere applicato sulla pelle sottoposta a radiazioni da una a 4 ore prima del trattamento quotidiano
- Considerare bendaggi e medicazioni avanzate in caso di desquamazione umida
- Prevenire superinfezioni
- Considerare antimicrobici topici o sistemici in caso di infezione
- In caso di RID di grado 3, va fatto tutto il possibile per cercare di non interrompere la RT
- In caso di RID di grado 4, considerare la sospensione della RT
RID, radiation-induced dermatitis; RT, radiation therapy
Al momento, non esiste alcun trattamento standard per la RID ed è stato chiesto un approccio più razionale alla terapia per questa patologia.(4) Per raccogliere evidenze di alto livello sul tema dovrebbero essere condotti studi prospettici appropriatamente disegnati, possibilmente RCT, sulla RID, che attualmente mancano. Tali studi dovrebbero considerare PRO e misure di qualità della vita come principali misure degli esiti. Un’importante insidia è la mancanza di uno strumento oggettivo affidabile per valutare la RID. I metodi usati e segnalati in letteratura sono la spettrofotometria in riflettanza, una tecnica non invasiva volta a misurare i pigmenti cellulari, e la misurazione dell’acqua transepidermica (TEWL), per analizzare la funzione della barriera epidermica.(83,84)
Per superare gli attuali dubbi e aiutare i medici a trattare i pazienti con RID, di seguito forniamo alcuni consigli pratici che possono essere facilmente suggeriti ai pazienti (Riquadro 1).
La terapia ideale per la RID dovrebbe presentare una serie di caratteristiche ed essere basata su una fondata selezione di componenti. Primo, i pazienti oncologici sono in quasi tutti i casi polimedicati e ricevono una serie di trattamenti associati a fastidiosi eventi avversi. Quindi, in linea con le precedenti raccomandazioni in ambito dermatologico, si potrebbe preferire un prodotto topico per curare la RID, con un rischio limitato di assorbimento sistemico e interazione farmaco-farmaco.(30) Inoltre, il prodotto dovrebbe far fronte alla complessa gamma di manifestazioni della RID e quindi dovrebbe essere caratterizzato da associazioni di alcuni principi attivi selezionati con diversi meccanismi di azione o target e molteplici attività cliniche per contrastare sintomi così diversi. Agenti in grado di prevenire gli eventi più precoci, come la produzione di radicali liberi dell’ossigeno o mediatori infiammatori, dovrebbero essere associati a molecole in grado di stimolare guarigione e rigenerazione. In particolare, poiché il dolore è riconosciuto come il sintomo più seccante associato a RID, andrebbe prestata particolare attenzione al suo trattamento. La ricerca in questo campo di molecole con un’azione consolidata sul dolore localizzato (ad es., la carnitina 85,86) può essere di grandissimo interesse.
Tuttavia, la necessità di diverse azioni dovrebbe essere confrontata con la necessità di limitare il rischio di eventi avversi e interazioni farmaco-farmaco, quindi dovrebbe essere incluso il minor numero possibile di componenti. Inoltre, dovrebbe essere accuratamente scelta la formulazione: ad esempio, una fase oleosa potrebbe bloccare la penetrazione del raggio della RT. Pertanto, formulazioni senza una fase oleosa, come i gel, potrebbero essere preferiti a quelle che la contengono (ad esempio, le creme).
Anche un’adeguata scelta del veicolo riveste un ruolo importante, poiché potrebbe influenzare la penetrazione nei diversi strati della pelle e successivamente le cellule target raggiunte. Le formulazioni liposomiali sono in grado di penetrare uniformemente lo strato calloso determinando una concentrazione locale da 4 a 14 volte superiore rispetto alle tradizionali emulsioni.(87) Inoltre, al di là del loro ruolo di portatori, i liposomi possono essere considerati principi attivi, data la loro ricchezza di fosfolipidi e acidi grassi omega, per il trattamento della cute secca e squamosa.(87) In uno studio in vitro, un liposoma di fosfatidilcolina ascorbato ha mostrato di superare lo strato corneo e rilasciare il principio attivo nel derma per prevenire il fotodanneggiamento.(88) Questi risultati sono stati replicati in un altro studio sperimentale.(89)
Quindi, un prodotto topico contenente componenti accuratamente selezionate per trattare dolore, danno cutaneo e altri sintomi seccanti di RID, rilasciato attraverso un appropriato veicolo, che assicuri allo stesso tempo proprietà chimico-fisiche ottimali sarebbe di grande interesse nell’attuale scenario terapeutico per la RID. Un tale composto potrebbe essere utilizzato anche nel contesto preventivo, in linea con recenti suggerimenti,(4) per limitare l’insorgenza di RID, migliorare la qualità della vita e ridurre il rischio di interruzione della RT.
Contributions: All authors contributed equally to the preparation of this review. All named authors meet the International Committee of
Medical Journal Editors (ICMJE) criteria for authorship for this article, take responsibility for the integrity of the work as a whole, and have given
their approval for this version to be published.
Disclosure and potential conflicts of interest: LG is the owner of Polistudium, the consultancy agency involved in
the editorial assistance of the present paper. The other authors declare that they have no conflicts of interest. The International
Committee of Medical Journal Editors (ICMJE) Potential Conflicts of Interests form for the authors is available for download at: https://www.drugsincontext.com/wp-content/uploads/2020/05/dic.2020-4-7-COI.pdf
Acknowledgements: Editorial assistance was provided by Aashni Shah, Barbara Bartolini, and Laura Brogelli, MD (Polistudium, Milan, Italy).
Funding declaration: Editorial assistance was supported by Welcare Industries.
Copyright: All Copyright © 2020 Iacovelli NA, Torrente Y, Ciuffreda A, Guardamagna AV, Gentili M, Giacomelli L, Sacerdote P. Published by Drugs in Context under Creative Commons License Deed CC BY NC ND 4.0 which allows anyone to copy, distribute, and transmit the article provided it is properly attributed in the manner specified below. No commercial use without permission.
Correct attribution: All Copyright © 2020 Iacovelli NA, Torrente Y, Ciuffreda A, Guardamagna AV, Gentili M, Giacomelli L, Sacerdote P. https://doi.org/10.7573/dic.2020-4-7 Published by Drugs in Context under Creative Commons License Deed CC BY NC ND 4.0.
Correspondence: Luca Giacomelli, Polistudium SRL, Milan, Italy. – luca.giacomelli@polistudium.it
Provenance: submitted; externally peer reviewed.
Submitted: 14 April 2020; Peer review comments to author: 4 May 2020; Revised manuscript received: 15 May 2020;
Accepted: 18 May 2020; Publication date: 12 June 2020.
Drugs in Context is published by BioExcel Publishing Ltd. Registered office: Plaza Building, Lee High Road, London, England, SE13 5PT.
BioExcel Publishing Limited is registered in England Number 10038393. VAT GB 252 7720 07.
For all manuscript and submissions enquiries, contact the Editor-in-Chief – gordon.mallarkey@bioexcelpublishing.com
For all permissions, rights and reprints, contact David Hughes – david.hughes@bioexcelpublishing.com
References
- Rosenthal A, Israilevich R, Moy R. Management of acute radiation dermatitis: a review of the literature and proposal for treatment algorithm. J Am Acad Dermatol. 2019;81(2):558–567. https://doi.org/10.1016/j.jaad.2019.02.047
- Iacovelli NA, Galaverni M, Cavallo A, et al. Prevention and treatment of radiation-induced acute dermatitis in head and neck cancer patients: a systematic review. Future Oncol. 2018;14(3):291–305. https://doi.org/10.2217/fon-2017-0359
- Russi EG, Moretto F, Rampino M, et al. Acute skin toxicity management in head and neck cancer patients treated with radiotherapy and chemotherapy or EGFR inhibitors: literature review and consensus. Crit Rev Oncol Hematol. 2015;96(1):167-182. https://doi.org/10.1016/j.critrevonc.2015.06.001
- Seité S, Bensadoun RJ, Mazer JM. Prevention and treatment of acute and chronic radiodermatitis. Breast Cancer (Dove Med Press). 2017;9:551–557. https://doi.org/10.2147/BCTT.S149752
- Matovina C, Birkeland AC, Zick S, et al. Integrative medicine in head and neck cancer. Otolaryngol Head Neck Surg. 2017;156(2): 228–237. https://doi.org/10.1177/0194599816671885
- Schnur JB, Love B, Scheckner BL, et al. A systematic review of patient-rated measures of radiodermatitis in breast cancer radiotherapy. Am J Clin Oncol. 2011;34(5):529–536.
- Presta G, Puliatti A, Bonetti L, et al. Effectiveness of hyaluronic acid gel (Jalosome soothing gel) for the treatment of radiodermatitis in a patient receiving head and neck radiotherapy associated with cetuximab: a case report and review. Int Wound J. 2019;16(6):1433–1439. https://doi.org/10.1111/iwj.13210
- Beamer LC, Grant M. Using the Dermatology Life Quality Index to assess how breast radiodermatitis affects patients’ quality of life. Breast Cancer (Auckl). 2019;13:1178223419835547. https://doi.org/10.1177/1178223419835547
- Sutherland AE, Bennett NC, Herst PM. Psychological stress affects the severity of radiation-induced acute skin reactions in breast cancer patients. Eur J Cancer Care (Engl). 2017;26(6). https://doi.org/10.1111/ecc.12737
- Kodiyan J, Amber KT. Topical antioxidants in radiodermatitis: a clinical review. Int J Palliat Nurs. 2015;21(9):446–452. https://doi.org/10.12968/ijpn.2015.21.9.446
- Chan RJ, Larsen E, Chan P. Re-examining the evidence in radiation dermatitis management literature: an overview and a critical appraisal of systematic reviews. Int J Radiat Oncol Biol Phys. 2012;84(3):e357–e362. https://doi.org/10.1016/j.ijrobp.2012.05.009
- Hegedus F, Mathew LM, Schwartz RA. Radiation dermatitis: an overview. Int J Dermatol. 2017;56(9):909–914. https://doi.org/10.1111/ijd.13371
- Bray FN, Simmons BJ, Wolfson AH, Nouri K. Acute and chronic cutaneous reactions to ionizing radiation therapy. Dermatol Ther (Heidelb). 2016;6(2):185–206. https://doi.org/10.1007/s13555-016-0120-y
- McQuestion M. Evidence-based skin care management in radiation therapy: clinical update. Semin Oncol Nurs. 2011;27:e1–e17. https://doi.org/10.1016/j.soncn.2011.02.009
- Iacovelli NA, Naimo S, Bonfantini F, et al. Preemptive treatment with Xonrid®, a medical device to reduce radiation induced dermatitis in head and neck cancer patients receiving curative treatment: a pilot study. Support Care Cancer. 2017;25(6):1787–1795. https://doi.org/10.1007/s00520-017-3569-z
- Wickline MM. Prevention and treatment of acute radiation dermatitis: a literature review. Oncol Nurs Forum. 2004;31:237–247.
https://doi.org/10.1188/04.ONF.237-247 - de Pauli Paglioni M, Alves CGB, Fontes EK, et al. Is photobiomodulation therapy effective in reducing pain caused by toxicities related to head and neck cancer treatment? A systematic review. Support Care Cancer. 2019;27(11):4043–4054. https://doi.org/10.1007/s00520-019-04939-2
- Glover D, Harmer V. Radiotherapy-induced skin reactions: assessment and management. Br J Nurs. 2014;23(4):S28, S30–S35.
https://doi.org/10.12968/bjon.2014.23.Sup2.S28 - Ryan JL. Ionizing radiation: the good, the bad, and the ugly. J Invest Dermatol. 2012; 132(3 Pt 2):985–993. https://doi.org/10.1038/jid.2011.411
- Wong RK, Bensadoun RJ, Boers-Doets CB, et al. Clinical practice guidelines for the prevention and treatment of acute and late radiation reactions from the MASCC Skin Toxicity Study Group. Support Care Cancer. 2013;21(10):2933–2948. https://doi.org/10.1007/s00520-013-1896-2
- Kong M, Hong SE. Topical use of recombinant human epidermal growth factor (EGF)-based cream to prevent radiation dermatitis in breast cancer patients: a single-blind randomized preliminary study. Asian Pac J Cancer Prev. 2013;14(8):4859–4864. https://doi.org/10.7314/APJCP.2013.14.8.4859
- Ferreira EB, Vasques CI, Gadia R, et al. Topical interventions to prevent acute radiation dermatitis in head and neck cancer patients: a systematic review. Support Care Cancer. 2017;25(3):1001–1011. https://doi.org/10.1007/s00520-016-3521-7
- Schnur JB, Ouellette SC, Dilorenzo TA, et al. A qualitative analysis of acute skin toxicity among breast cancer radiotherapy patients. Psychooncology. 2011;20(3):260–268. https://doi.org/10.1002/pon.1734
- Whelan TJ, Pignol JP, Levine MN, et al. Long-term results of hypofractionated radiation therapy for breast cancer. N Engl J Med. 2010;362(6):513–520. https://doi.org/10.1056/NEJMoa0906260
- American Cancer Society. Cancer Facts & Figures 2017. Atlanta, GA: American Cancer Society; 2017. https://www.cancer.org/. Accessed October 12, 2017.
- Sibaud V, Leboeuf NR, Roche H, et al. Dermatological adverse events with taxane chemotherapy. Eur J Dermatol. 2016;26(5): 427–443. https://doi.org/10.1684/ejd.2016.2833
- Burris HA 3rd, Hurtig J. Radiation recall with anticancer agents. Oncologist. 2010;15(11):1227–1237. https://doi.org/10.1634/theoncologist.2009-0090
- Chan RJ, Webster J, Chung B, et al. Prevention and treatment of acute radiation-induced skin reactions: a systematic review and meta-analysis of randomized controlled trials. BMC Cancer. 2014;14:53. https://doi.org/10.1186/1471-2407-14-53
- Greenlee H, DuPont-Reyes MJ, Balneaves LG, et al. Clinical practice guidelines on the evidence-based use of integrative therapies during and following breast cancer treatment. CA Cancer J Clin. 2017;67(3):194–232. https://doi.org/10.3322/caac.21397
- Pereira MP, Ständer S. Therapy for pruritus in the elderly: a review of treatment developments. Expert Opin Pharmacother. 2018;19(5):443–450. https://doi.org/10.1080/14656566.2018.1444752
- Haas ML, Moore-Higgs GJ. Principles of Skin Care and the Oncology Patient. Pittsburgh, PA: Oncology Nursing Society; 2010.
- Hymes SR, Strom EA, Fife C. Radiation dermatitis: clinical presentation, pathophysiology, and treatment 2006. J Am Acad Dermatol. 2006;54:28–46. https://doi.org/10.1016/j.jaad.2005.08.054
- Campbell IR, Illingworth MH. Can patients wash during radiotherapy to the breast or chest wall? A randomized controlled trial. Clin Oncol. 1992;4(2):78–82. https://doi.org/10.1016/S0936-6555(05)80971-9
- Roy I, Fortin A, Larochelle M. The impact of skin washing with water and soap during breast irradiation: a randomized study. Radiother Oncol. 2001;58(3):333–339. https://doi.org/10.1016/S0167-8140(00)00322-4
- Hemati S, Asnaashari O, Sarvizadeh M, et al. Topical silver sulfadiazine for the prevention of acute dermatitis during irradiation for breast cancer. Support Care Cancer. 2012;20(8):1613–1618. https://doi.org/10.1007/s00520-011-1250-5
- Niazi T, Vuong T, Azoulay L, et al. Silver clear nylon dressing is effective in preventing radiation induced dermatitis in patients with gastrointestinal cancer: results from a phase III study. Int J Radiat Oncol Biol Phys. 2011;81(2):S171. https://doi.org/10.1016/j.ijrobp.2011.06.1679
- Aquino-Parsons C, Lomas S, Smith K, et al. Phase III study of silver leaf nylon dressing vs standard care for reduction of inframammary moist desquamation in patients undergoing adjuvant whole breast radiation therapy. J Med Imag Rad Sci.
2010;41(4):215–221. https://doi.org/10.1016/j.jmir.2010.08.005 - Zhong WH, Tang QF, Hu LY, et al. Mepilex Lite dressings for managing acute radiation dermatitis in nasopharyngeal carcinoma patients: a systematic controlled clinical trial. Med Oncol. 2013;30(4):761. https://doi.org/10.1007/s12032-013-0761-y
- Robijns J, Censabella S, Claes S, et al. Prevention of acute radiodermatitis by photobiomodulation: a randomized, placebo-controlled trial in breast cancer patients (TRANSDERMIS trial). Lasers Surg Med. 2018. https://doi.org/10.1002/lsm.22804. Epub ahead of print.
- Haruna F, Lipsett A, Marignol L. Topical management of acute radiation dermatitis in breast cancer patients: a systematic review and meta-analysis. Anticancer Res. 2017;37(10):5343–5353. https://doi.org/10.21873/anticanres.11960
- Ho AY, Olm-Shipman M, Zhang Z, et al. A randomized trial of mometasone furoate 0.1% to reduce high-grade acute radiation dermatitis in breast cancer patients receiving postmastectomy radiation. Int J Radiat Oncol Biol Phys. 2018;101(2): 325–333.
https://doi.org/10.1016/j.ijrobp.2018.02.006 - Zenda S, Yamaguchi T, Yokota T, et al. Topical steroid versus placebo for the prevention of radiation dermatitis in head and neck cancer patients receiving chemoradiotherapy: the study protocol of J-SUPPORT 1602 (TOPICS study), a randomized doubleblinded phase 3 trial. BMC Cancer. 2018;18(1):873. https://doi.org/10.1186/s12885-018-4763-1
- Liao Y, Feng G, Dai T, et al. Randomized, self-controlled, prospective assessment of the efficacy of mometasone furoate local application in reducing acute radiation dermatitis in patients with head and neck squamous cell carcinomas. Medicine (Baltimore). 2019;98(52):e18230. https://doi.org/10.1097/MD.0000000000018230
- Papier A, Strowd LC. Atopic dermatitis: a review of topical nonsteroid therapy. Drugs Context. 2018;7:212521.
https://doi.org/10.7573/dic.212521 - Jowkar F, Namazi MR. Statins in dermatology. Int J Dermatol. 2010;49(11):1235–1243. https://doi.org/10.1111/j.1365-4632.2010.04579.x
- Ghasemi A, Ghashghai Z, Akbari J, et al. Topical atorvastatin 1% for prevention of skin toxicity in patients receiving radiation therapy for breast cancer: a randomized, double-blind, placebo-controlled trial. Eur J Clin Pharmacol. 2019;6:1–8.
https://doi.org/10.1007/s00228-018-2570-x - Rahimi R, Abdollahi M. A systematic review of the topical drugs for post hemorrhoidectomy pain. Int J Pharmacol. 2012;8:628–637.
https://doi.org/10.3923/ijp.2012.628.637 - Wells M, Macmillan M, Raab G, et al. Does aqueous or sucralfate cream affect the severity of erythematous radiation skin reactions? A randomised controlled trial. Radiother Oncol. 2004;73(2):153–162. https://doi.org/10.1016/j.radonc.2004.07.032
- Falkowski S, Trouillas P, Duroux JL, Bonnetblanc JM, Clavere P. Radiodermatitis prevention with sucralfate in breast cancer: fundamental and clinical studies. Support Care Cancer. 2011;19(1):57–65. https://doi.org/10.1007/s00520-009-0788-y
- Elliott EA, Wright JR, Swann RS, et al. Phase III trial of an emulsion containing trolamine for the prevention of radiation dermatitis in patients with advanced squamous cell carcinoma of the head and neck: results of Radiation Therapy Oncology Group Trial 99-13. J Clin Oncol. 2006;24(13):2092–2097. https://doi.org/10.1200/JCO.2005.04.9148
- Fenig E, Brenner B, Katz A, et al. Topical Biafine and Lipiderm for the prevention of radiation dermatitis: a randomized prospective trial. Oncol Rep. 2001;8(2):305–309. https://doi.org/10.3892/or.8.2.305
- Gosselin TK, Schneider SM, Plambeck MA, Rowe K. A prospective randomized, placebo-controlled skin care study in women diagnosed with breast cancer undergoing radiation therapy. Oncol Nurs Forum. 2010;37(5). https://doi.org/10.1188/10.ONF.619-626
- Abbas H, Bensadoun RJ. Trolamine emulsion for the prevention of radiation dermatitis in patients with squamous cell carcinoma of the head and neck. Support Care Cancer. 2012;20(1):185–190. https://doi.org/10.1007/s00520-011-1110-3
- Shariati L, Amouheidari A, Naji Esfahani H, et al. Protective effects of doxepin cream on radiation dermatitis in breast cancer: A single arm double-blind randomized clinical trial. Br J Clin Pharmacol. 2020. https://doi.org/10.1111/bcp.14238
- Chan RJ, Blades R, Jones L, et al. A single-blind, randomised controlled trial of StrataXRT® – a silicone-based film-forming gel dressing for prophylaxis and management of radiation dermatitis in patients with head and neck cancer. Radiother Oncol. 2019;139:72‐78. https://doi.org/10.1016/j.radonc.2019.07.014
- Haubner F, Ohmann E, Pohl F, et al. Wound healing after radiation therapy: review of the literature. Radiat Oncol. 2012;7(1):162.
https://doi.org/10.1186/1748-717X-7-162 - Kang HC, Ahn SD, Choi DH, et al. The safety and efficacy of EGF-based cream for the prevention of radiotherapy-induced skin injury: results from a multicenter observational study. Rad Oncol J. 2014;32(3):156. https://doi.org/10.3857/roj.2014.32.3.156
- Kouvaris JR, Kouloulias VE, Plataniotis GA, et al. Topical granulocyte-macrophage colony-stimulating factor for radiation dermatitis of the vulva. Br J Dermatol. 2001;144:646–647. https://doi.org/10.1046/j.1365-2133.2001.04115.x
- Farrugia CE, Burke ES, Haley ME, et al. The use of aloe vera in cancer radiation: an updated comprehensive review. Complement Ther Clin Pract. 2019;35:126–130. https://doi.org/10.1016/j.ctcp.2019.01.013
- Heggie S, Bryant GP, Tripcony L, et al. A phase III study on the efficacy of topical aloe vera gel on irradiated breast tissue. Cancer Nurs. 2002;25(6):442–451. https://doi.org/10.1097/00002820-200212000-00007
- Atiyeh BS, Dham R, Kadry M, et al. Benefit-cost analysis of moist exposed burn ointment. Burns. 2002;28(7):659–663. https://doi.org/10.1016/S0305-4179(02)00075-X
- Geara FB, Eid T, Zouain N, et al. Randomized, prospective, open-label phase III trial comparing MEBO ointment with Biafine cream for the management of acute dermatitis during radiotherapy for breast cancer. Am J Clin Oncol. 2018;102(3):e610. https://doi.org/10.1016/j.ijrobp.2018.07.1672
- Gilca M, Tiplica GS, Salavastru CM. Traditional and ethnobotanical dermatology practices in Romania and other Eastern European countries. Clin Dermatol. 2018;36(3):338–352. https://doi.org/10.1016/j.clindermatol.2018.03.008
- Pommier P, Gomez F, Sunyach MP, et al. Phase III randomized trial of Calendula officinalis compared with trolamine for the prevention of acute dermatitis during irradiation for breast cancer. J Clin Oncol. 2004;22:1447–1453. https://doi.org/10.1200/JCO.2004.07.063
- Schneider F, Danski MT, Vayego SA. Usage of Calendula officinalis in the prevention and treatment of radiodermatitis: a randomized double-blind controlled clinical trial. Rev Esc Enferm USP. 2015;49(2):221–228. https://doi.org/10.1590/S0080-623420150000200006
- Friedrich EE, Sun LT, Natesan S, et al. Effects of hyaluronic acid conjugation on anti-TNF-α inhibition of inflammation in burns. J Biomed Mater Res A. 2014;102(5):1527–1536. https://doi.org/10.1002/jbm.a.34829
- Chen LH, Xue JF, Zheng ZY, et al. Hyaluronic acid, an efficient biomacromolecule for treatment of inflammatory skin and joint diseases: A review of recent developments and critical appraisal of preclinical and clinical investigations. Int J Biol Macromol. 2018;116:572–584. https://doi.org/10.1016/j.ijbiomac.2018.05.068
- Paganelli A, Mandel VD, Pellacani G, et al. Synergic effect of plasma exeresis and non-cross-linked low and high molecular weight hyaluronic acid to improve neck skin laxities. J Cosmet Dermatol. 2020;19(1):55–60. https://doi.org/10.1111/jocd.12976
- Gracy RLK, Phelps J. RadiaPlexRx Gel Protects Cultured Skin Cells from Oxidative Free Radical Damage Induced by Hydrogen Peroxide and by Irradiation: A Pilot Study. SSA20-08. Chicago, IL: Radiological Society of North America; 2005:300
- Liguori V, Guillemin C, Pesce GF, et al. Double-blind, randomized clinical study comparing hyaluronic acid cream to placebo in patients treated with radiotherapy. Radiother Oncol. 1997;42(2):155–161. https://doi.org/10.1016/S0167-8140(96)01882-8
- Cosentino D, Piro F. Hyaluronic acid for treatment of the radiation therapy side effects: a systematic review. Eur Rev Med Pharmacol Sci. 2018;22(21):7562–7572. https://doi.org/10.26355/eurrev_201811_16298
- Franco P, Potenza I, Moretto F, et al. Hypericum perforatum and neem oil for the management of acute skin toxicity in head and neck cancer patients undergoing radiation or chemo-radiation: a single-arm prospective observational study. Radiat Oncol. 2014;9:297. https://doi.org/10.1186/s13014-014-0297-0
- Huang CJ, Huang MY, Fang PT, et al. Randomized double-blind, placebo-controlled trial evaluating oral glutamine on radiation-induced oral mucositis and dermatitis in head and neck cancer patients. Am J Clin Nutr. 2019;109(3):606–614. doi:10.1093/ajcn/nqy329
- Scalia S, Marchetti N, Bianchi A. Comparative evaluation of different co-antioxidants on the photochemical- and functionalstability of epigallocatechin-3-gallate in topical creams exposed to simulated sunlight. Molecules. 2013;18:574–587. https://doi.org/10.3390/molecules18010574
- Zhao H, Zhu W, Jia L, et al. Phase I study of topical epigallocatechin-3-gallate (EGCG) in patients with breast cancer receiving adjuvant radiotherapy. Br J Radiol. 2015;89(1058):20150665. https://doi.org/10.1259/bjr.20150665
- Zhu W, Jia L, Chen G, et al. Epigallocatechin-3-gallate ameliorates radiation-induced acute skin damage in breast cancer patients undergoing adjuvant radiotherapy. Oncotarget. 2016;7(30):48607. https://doi.org/10.18632/oncotarget.9495
- Halperin EC, Perez CA, Brady LW. The discipline of radiation oncology. In: Halperin EC, Perez CA, Brady LW, eds. Principles and Practice of Radiation Oncology. Philadelphia, PA: Lippincott Williams & Wilkins; 2008:2–75.
- Reynolds JEF, ed. Martindale: The Extra Pharmacopoeia. 30th ed. Dexpanthenol. London: The Pharmaceutical Press; 1993:1361.
- Chan RJ, Mann J, Tripcony L, et al. Natural oil-based emulsion containing allantoin versus aqueous cream for managing radiationinduced
skin reactions in patients with cancer: a phase 3, double-blind, randomized, controlled trial. Int J Radiat Oncol Biol Phys. 2014;90(4):756–764. https://doi.org/10.1016/j.ijrobp.2014.06.034 - Manas A, Santolaya M, Ciapa VM, et al. Topical R1 and R2 prophylactic treatment of acute radiation dermatitis in squamous cell carcinoma of the head and neck and breast cancer patients treated with chemoradiotherapy. Eplasty. 2015;15:e25.
- Cui Z, Xin M, Yin H, et al. Topical use of olive oil preparation to prevent radiodermatitis: results of a prospective study in nasopharyngeal carcinoma patients. Int J Clin Exp Med. 2015;8(7):11000–11006.
- Palatty PL, Azmidah A, Rao S, et al. Topical application of a sandal wood oil and turmeric based cream prevents radiodermatitis in head and neck cancer patients undergoing external beam radiotherapy: a pilot study. Br J Radiol. 2014;87(1038):20130490. https://doi.org/10.1259/bjr.20130490
- Carrara M, Giandini T, Pariani C, et al. Comment on objective assessment in digital images of skin erythema caused by radiotherapy. Med Phys. 2016;43(5):2687. https://doi.org/10.1118/1.4945019
- Pazdrowski J, Polaſska A, Kaźmierska J, et al. Skin barrier function in patients under radiation therapy due to the head and neck cancers – preliminary study. Rep Pract Oncol Radiother. 2019;24(6):563–567.
- Salama SA, Arab HH, Omar HA, et al. L-carnitine mitigates UVA-induced skin tissue injury in rats through downregulation of oxidative stress, p38/c-Fos signaling, and the proinflammatory cytokines. Chem Biol Interact. 2018;285:40–47. https://doi.org/10.1016/j.cbi.2018.02.034
- Di Stefano G, Di Lionardo A, Galosi E, et al. Acetyl-L-carnitine in painful peripheral neuropathy: a systematic review. J Pain Res. 2019;12:1341–1351. https://doi.org/10.2147/JPR.S190231
- Giacomelli L, Moglia A, Losa G, Quaglino P. Clinical use of Capilen, a liposomal cream based on fresh plant extracts enriched with omega fatty acids. Drugs Context. 2020;9:2019-10-1. https://doi.org/10.7573/dic.2019-10-1
- Serrano G, Almudéver P, Serrano JM, et al. Phosphatidylcholine liposomes as carriers to improve topical ascorbic acid treatment of skin disorders. Clin Cosmet Investig Dermatol. 2015;8:591–599. https://doi.org/10.2147/CCID.S90781
- Brand RM, Epperly MW, Stottlemyer JM, et al. A topical mitochondria-targeted redox cycling nitroxide mitigates oxidative stress induced skin damage. J Invest Dermatol. 2017;137(3):576–586. https://doi.org/10.1016/j.jid.2016.09.033
- Imai T, Matsuura K, Asada Y, et al. Effect of HMB/Arg/Gln on the prevention of radiation dermatitis in head and neck cancer patients treated with concurrent chemoradiotherapy. Jpn J Clin Oncol. 2014;44(5):422–427. https://doi.org/10.1093/jjco/hyu027


